吡格列酮Duetact Glimepiride——Duetact完整的处方信息
品牌名称:Duetact
通用名:盐酸吡格列酮和Glimepiride
内容:
描述
药理学
适应症和用法
禁忌症
警告
预防措施
不良反应
过量
剂量和管理
如何提供
引用
眼科学数据
Duetact,盐酸吡格列酮和glimepiride病人信息(简明英语)
- Thiazolidinediones,包括吡格列酮,Duetact的一个组成部分,在一些病人中引起或加剧充血性心力衰竭(见警告盐酸吡格列酮)。Duetact启动后,仔细观察患者心力衰竭的症状和体征(包括快速的过度,体重增加、呼吸困难和/或水肿)。如果这些迹象和症状,心脏衰竭应根据当前标准的护理管理。此外,中止Duetact必须考虑。
- Duetact不推荐患者有症状的心力衰竭。患者开始Duetact建立类NYHA III或IV心脏衰竭是禁忌(见禁忌症和警告盐酸吡格列酮)。
描述
Duetact™(盐酸吡格列酮和glimepiride)平板电脑包含两个口服降糖药代理用于2型糖尿病的管理:盐酸吡格列酮和glimepiride。伴随使用吡格列酮和磺酰脲类,类的药物,包括glimepiride,基于临床试验之前已经批准在2型糖尿病患者控制不足的磺酰脲类。额外的吡格列酮疗效和安全性信息和glimepiride单方可能发现在每个药品的处方信息。
盐酸吡格列酮是一种口服降糖药,行为主要是通过降低胰岛素抵抗。吡格列酮用于2型糖尿病的管理。药理研究表明,吡格列酮改善在肌肉和脂肪组织对胰岛素的敏感性,抑制肝醣类。吡格列酮改善血糖控制,同时减少循环胰岛素水平。
吡格列酮(±)5 - [[4 - (2 - (5-ethyl-2-pyridinyl)乙氧基)苯基)甲基]2,4-thiazolidinedione monohydrochloride属于不同的化学类和比磺酰脲类药物有不同的药理作用,双胍类,或者我±葡糖苷酶抑制剂。分子含有一个不对称中心,和合成化合物是一种外消旋体。体内的两个对映体吡格列酮互变。结构式如图所示:
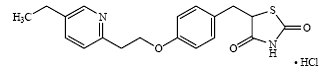
盐酸吡格列酮
盐酸吡格列酮是一种无味、白色晶体粉末,分子式为C19H20.N2O3S-HCl和分子量为392.90。它是溶于N, N-dimethylformamide,微溶于无水乙醇,微溶于丙酮和乙腈,几乎不溶于水,不溶于醚。
Glimepiride 1 - [[p - [2 - (3-ethyl-4-methyl-2-oxo-3-pyrroline-1-carboxamido)乙基]]苯磺酰)3 - (trans-4-methylcyclohexyl)尿素是磺酰脲类口服降糖药物血类和用于2型糖尿病的管理。分子的反式异构体对环己基取代基。化学结构如图所示:
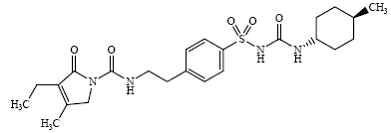
Glimepiride
Glimepiride黄白色为白色至类白色结晶,无臭,几乎无味的粉末,C的分子式24 h34N4O5年代和分子量为490.62。溶于二甲亚砜,微溶于丙酮,微溶于乙腈和甲醇,几乎不溶于水。
Duetact可以作为平板口服药包含30毫克盐酸吡格列酮(基础)2毫克glimepiride(30毫克/ 2毫克)或30毫克盐酸吡格列酮(基地)4毫克glimepiride(30毫克/ 4毫克)制定以下辅料:聚维酮USP, croscarmellose NF,钠一水乳糖NF,硬脂酸镁NF,羟丙基纤维素NF,聚山梨醇酯80 NF和微晶纤维素NF。
临床药理学
的作用机制
Duetact
Duetact结合了两种降糖药代理不同机制的行动来改善2型糖尿病患者的血糖控制:盐酸吡格列酮,thiazolidinedione阶级的一员,和glimepiride,磺酰脲类类的一个成员。Thiazolidinediones insulin-sensitizing代理,主要是通过加强外围葡萄糖利用率,而磺酰脲类药物胰岛素secretogogues行为主要通过刺激胰腺β细胞的胰岛素释放运作。
盐酸吡格列酮
吡格列酮的存在取决于胰岛素的作用机制。吡格列酮降低胰岛素抵抗在外围和肝脏导致增加胰岛素依赖型葡萄糖处理和减少肝脏葡萄糖输出。吡格列酮是一个有力的和高度选择性受体激动剂,过氧物酶体proliferator-activated receptor-gamma (PPARI³)。PPAR对胰岛素受体组织中发现的重要行动,如脂肪组织,骨骼肌和肝脏。激活PPARI³核受体调节的胰岛素反应基因的转录参与葡萄糖和脂类代谢的控制。
吡格列酮在糖尿病动物模型,降低高血糖、高胰岛素血症、高甘油三酯血症的特点2型糖尿病胰岛素抵抗等州。吡格列酮产生的代谢变化导致增加胰岛素依赖型的响应性组织,观察到大量的胰岛素抵抗动物模型。
由于吡格列酮增强循环胰岛素的影响(通过减少胰岛素抵抗),它不缺乏内源性胰岛素降低血糖在动物模型。
Glimepiride
主glimepiride降低血糖的作用机制似乎依赖于刺激胰腺β细胞的胰岛素释放运作。此外,extrapancreatic效应也可能扮演一个角色在glimepiride等磺脲类的活动。这是支持的临床前和临床研究证明glimepiride管理会导致增加周围组织对胰岛素的敏感性。这些发现符合长期的结果,随机、安慰剂对照试验中glimepiride疗法改善餐后胰岛素/ c -肽反应和总体血糖控制不生产临床有意义的增加空腹胰岛素/ c -肽水平。然而,与其他磺酰脲类药物的机制glimepiride降低血糖长期执政期间尚未明确。
药物动力学和药物代谢
吸收和生物利用度
Duetact
生物等效性研究进行了以下的单剂量Duetact 30毫克/ 2毫克和30毫克/ 4毫克平板电脑和伴随管理ACTOS(30毫克)和glimepiride(2毫克或4毫克)在健康受试者在禁食条件下。雷竞技到底好不好用
基于曲线下的面积(AUC)和最大浓度(C马克斯)吡格列酮和glimepiride Duetact 30毫克/ 2毫克和30毫克/ 4毫克bioequivalent ACTOS 30毫克与此同时管理与glimepiride(分别为2毫克或4毫克)(表1)。
表1。意味着Duetact (SD)药代动力学参数
| 养生法 | N | AUC (0-inf) (ng·h /毫升) |
N | C马克斯 (ng / mL) |
N | T马克斯 (h) |
N | T1/2 (h) |
|
| Duetact 30毫克/ 2毫克 | 吡格列酮 | 32 | 10116年 (3641) |
34 | 986年 (433) |
34 | 2.12 (1.10) |
32 | 10.43 (5.08) |
| glimepiride | 34 | 871年 (342) |
34 | 168年 (57.1) |
34 | 2.53 (0.73) |
34 | 8.23 (4.18) |
|
| 30毫克吡格列酮+ 2毫克glimepiride平板电脑 |
吡格列酮 | 32 | 11870年 (3779) |
34 | 1011年 (406) |
34 | 2.22 (1.38) |
32 | 11.83 (4.39) |
| glimepiride | 34 | 863年 (340) |
34 | 190年 (61.6) |
34 | 2.29 (1.17) |
34 | 6.47 (2.76) |
|
| Duetact 30毫克/ 4毫克 | 吡格列酮 | 36 | 10676年 (3031) |
37 | 1103年 (317) |
37 | 1.84 (0.96) |
36 | 9.64 (3.63) |
| glimepiride | 36 | 2435年 (3063) |
37 | 308年 (110) |
37 | 2.71 (0.67) |
36 | 11.01 (5.34) |
|
| 30毫克吡格列酮+ 4毫克glimepiride平板电脑 |
吡格列酮 | 36 | 12179年 (3481) |
37 | 1188年 (342) |
37 | 2.17 (1.06) |
36 | 10.47 (4.65) |
| glimepiride | 36 | 2432年 (3217) |
37 | 360年 (133) |
37 | 2.73 (1.15) |
36 | 9.56 (4.32) |
食物没有改变系统性风险敞口glimepiride或吡格列酮Duetact管理。食品的存在并没有显著改变glimepiride的血清浓度峰值的时间。然而,对于吡格列酮,延迟时间达到峰值浓度从1.6到3.6小时与食品管理。这依然延迟时间达到最大血清浓度(T马克斯)也是最大下降9%血清浓度(C马克斯)吡格列酮。这些变化不太可能是临床意义重大。
盐酸吡格列酮
吡格列酮口服后,在空腹状态下,首先是血清中可测不到30分钟,与峰值浓度观察2小时内。食物稍微延迟血清浓度达到峰值的时间3至4小时,但不改变吸收的程度。
Glimepiride
口服后,glimepiride完全(100%)从胃肠道吸收。研究单一口服剂量在正常受试者和多个在2型糖尿病患者口服剂量显示显著的吸收glimepiride后1小时内管理和Cmax在2到3个小时。glimepiride鉴于在吃饭的时候,平均最高温度略有增加(12%)和平均Cmax和血清浓度时间曲线下面积(AUC)略有下降(分别为8%和9%)。
分布
盐酸吡格列酮
平均表观分布容积(Vd / F)吡格列酮的单剂后政府0.63±0.41 (±SD) L /公斤的体重。吡格列酮是广泛蛋白质绑定在人类血清(> 99%),主要是血清白蛋白。吡格列酮也与其他血清蛋白质结合,但较低的亲和力。代谢物M-III和M-IV也广泛结合血清白蛋白(> 98%)。
Glimepiride
静脉注射(IV)剂量后在正常受试者,Vd / F是8.8 L(113毫升/公斤),和全身间隙(CL)为47.8毫升/分钟。蛋白结合大于99.5%。
新陈代谢
盐酸吡格列酮
吡格列酮是由羟基化广泛代谢和氧化;硫酸代谢物也部分地转化为葡糖苷酸或共轭。代谢物M-II和M-IV(羟基吡格列酮的衍生物)和M-III(酮吡格列酮的衍生物)药物活性的2型糖尿病动物模型。除了吡格列酮,M-III和M-IV校长与毒品有关的物种在人类多次给药后血清。在稳定状态,在健康的志愿者和在2型糖尿病患者,吡格列酮由大约30%到50%的总血清浓度峰值和AUC总数的20%至25%。
体外数据证明涉及多个CYP亚型在吡格列酮的代谢。涉及的细胞色素P450亚型CYP2C8,程度较轻,CYP3A4从各种其他亚型包括额外的贡献主要是肝外CYP1A1。吡格列酮的体内研究结合P450酶抑制剂和底物(见执行预防措施、药物相互作用、盐酸吡格列酮)。尿6 aÿ-hydroxycortisol /吡格列酮患者皮质醇比率测量表明,吡格列酮并不是一个强大的CYP3A4酶诱导物。
Glimepiride
Glimepiride完全氧化代谢的生物转化后留置针或口服剂量。的主要代谢物羟基甲基环己酯衍生品(M1)和羧基衍生品(M2)。CYP2C9已被证明是参与生物转化glimepiride M1。M1是由一个或几个进一步代谢M2胞质酶。M1,但不是平方米,拥有大约1/3的药理作用与母公司在动物模型;然而,M1的降糖效果是否有临床意义还不清楚。
排泄和消除
盐酸吡格列酮
口服后,大约有15%到30%的吡格列酮剂量是尿液中恢复过来。肾脏消除吡格列酮可以忽略不计,药物主要是代谢产物的排泄出来和他们的配合。据推测,大部分的口服剂量分泌到胆汁不变或代谢物和消除粪便。
吡格列酮和吡格列酮总范围的平均血清半衰期从3 - 7小时,16到24小时,分别。吡格列酮有明显的间隙,CL / f,计算5至7 L /人力资源。
Glimepiride
14 c-glimepiride口服时,大约60%的总放射性在尿液在7天内恢复,M1(主要)和M2占80 - 90%,尿液中恢复过来。大约40%的总放射性恢复在粪便和M1和M2(主要)约占70%,在粪便中恢复过来。没有父母药物从尿液或粪便中恢复过来。静脉注射剂量的病人后,没有明显的胆汁排泄glimepiride或其M1代谢物被观察到。
特殊人群
肾功能不全
盐酸吡格列酮
吡格列酮的血清消除半衰期,M-III M-IV中度患者保持不变(肌酐清除率30到60毫升/分钟)严重(肌酐清除率< 30 mL / min)肾功能损害与正常人相比。不建议剂量调整患者的肾功能障碍。
Glimepiride
单剂,进行了开放研究15肾功能损害的患者。Glimepiride(3毫克)是管理3组患者的不同级别的意思是肌酐清除率(CLcr);(集团我CLcr = 77.7 mL / min, n = 5),(组二世,CLcr = 27.7 mL / min, n = 3),和(第三组,CLcr = 9.4 mL / min, n = 7)。Glimepiride被发现在所有3组耐受性良好。结果表明,glimepiride血清水平下降,肾功能下降。然而,M1和M2血清水平(平均AUC值)增加了2.3和8.6倍从第三组我组。明显的终端半衰期(T1/2) glimepiride并未改变,而M1和M2的半衰期增加肾功能下降。意思是尿排泄的M1 + M2作为剂量的百分比,然而,减少(44.4%、21.9%、9.3%,组我III)。
multiple-dose滴定研究也进行了16 2型糖尿病患者肾功能损害使用剂量范围从1 - 8毫克每天3个月。结果是一致的与单剂后观察。所有患者CLcr小于22毫升/分钟已经足够控制他们的血糖水平每天只有1毫克的给药方案。这项研究的结果表明,起始剂量的1毫克glimepiride可能给患者2型糖尿病和肾病,和剂量可能根据空腹血糖水平(见滴定剂量和管理、特殊患者群体)。
肝功能不全
盐酸吡格列酮
与正常对照组相比,主题与肝脏功能受损(儿童年级B / C)有一个近似减少45%吡格列酮和吡格列酮总意味着峰值浓度,但没有改变的意思是AUC值。
治疗Duetact不应启动如果病人表现出活跃的肝脏疾病的临床证据或血清转氨酶(ALT)水平超过正常上限的2.5倍(见预防措施将军:盐酸吡格列酮,肝的影响)。
Glimepiride
肝功能不全患者进行了研究。
上了年纪的
盐酸吡格列酮
在健康的老年人,血清浓度的吡格列酮和吡格列酮总峰值不明显不同,但AUC值略高,终端半衰期值稍长一些的比年轻的学科。这些变化并不会被视为临床相关的级。
Glimepiride
比较glimepiride药物动力学在2型糖尿病患者‰¤65年,> 65年进行的一项研究使用6毫克每日给药方案。之间没有明显的差异glimepiride药物动力学两个年龄组。在稳态均值AUC的老年患者约13%低于年轻的病人;老年患者平均体重调整一下给间隙是对年轻病人的高出11%。
儿科
没有药代动力学的研究Duetact儿科患者中进行。
性别
盐酸吡格列酮
作为单一疗法,结合磺酰脲类、二甲双胍或胰岛素,吡格列酮改善血糖控制在雄性和雌性。C均值马克斯和AUC值在女性增加了20%到60%。在对照临床试验中,糖化血红蛋白(A1C)减少从基线通常是更大的女性比男性(平均差平均糖化血红蛋白0.5%)。因为治疗应达到的每个病人的血糖控制,不推荐仅根据性别调整剂量。
Glimepiride
没有区别男性和女性的药物动力学glimepiride调整时体重的差异。
种族
盐酸吡格列酮
药代动力学数据在不同民族并不可用。
Glimepiride
没有药代动力学研究来评估影响的种族已经执行,但在安慰剂对照研究2型糖尿病患者的glimepiride降糖药效果类似于白人(n = 536), (n = 63),黑人和西班牙裔(n = 63)。
其他人群
Glimepiride
没有重要的差异在主题确定为glimepiride代谢表型不同drug-metabolizers金雀花碱的代谢。glimepiride病态肥胖患者的药物动力学是类似于那些正常体重组,除了降低C马克斯和AUC。然而,因为无论是C马克斯用体表面积和AUC值归一化,C值越低马克斯和AUC肥胖病人有可能他们的体重超标的结果而不是由于不同glimepiride的动力学。
药物之间相互作用
合并施打吡格列酮(45毫克)和磺酰脲类(5毫克格列吡嗪)每日口服一次,7天没有改变格列吡嗪的稳态药物动力学。Glimepiride和格列吡嗪相似的代谢途径是由CYP2C9;因此,吡格列酮药物之间相互作用和glimepiride被认为是不可能的。特定的药代动力学药物相互作用研究Duetact尚未执行,尽管这样的研究已经进行了单独的吡格列酮和glimepiride组件。
盐酸吡格列酮
下列药物合并施打吡格列酮在健康的志愿者进行了研究45毫克每日一次。结果下面列出:
口服避孕药:合并施打吡格列酮(45毫克每日一次)和口服避孕药(1毫克炔诺酮+乙炔雌二醇0.035毫克每日一次)21天,导致乙炔雌二醇下降11%和11 - 14% AUC (0-24h)和C马克斯分别。没有明显的变化炔诺酮AUC (0-24h)和C马克斯。针对高可变性的乙炔基雌二醇药物动力学,这一发现的临床意义是未知的。
咪达唑仑:政府吡格列酮的15天之后,一个7.5毫克剂量咪达唑仑糖浆导致减少26%咪达唑仑C马克斯和AUC。
硝苯地平ER:合并施打吡格列酮为7天30毫克硝苯地平ER连续4天每天口服一次的男性和女性志愿者导致比最小二乘均值不变硝苯地平(90% CI)值为0.83(0.73 - 0.95)的C马克斯和AUC 0.88 (0.80 - 0.96)。针对高可变性的硝苯地平药物动力学,这一发现的临床意义是未知的。
酮康唑:合并施打吡格列酮与酮康唑200毫克注射7天每天两次导致比最小二乘法的意思是不变的吡格列酮(90% CI)值为1.14 (1.06 - 1.23)C马克斯AUC, 1.34(1.26 - 1.41)和1.87 (1.71 - 2.04)C分钟。
阿托伐他汀钙:合并施打吡格列酮与阿托伐他汀钙(立普妥®)7天每天80毫克一次导致比最小二乘法的意思是不变的吡格列酮(90% CI)值为0.69 (0.57 - 0.85)C马克斯AUC, 0.76(0.65 - 0.88)和0.96 (0.87 - 1.05)C最小值。阿托伐他汀对不变,最小平方的比值的意思是(90% CI)值为0.77 (0.66 - 0.90)C马克斯AUC, 0.86(0.78 - 0.94)和0.92 (0.82 - 1.02)C最小值。
细胞色素P450:看预防措施、药物相互作用、盐酸吡格列酮
二甲苯氧庚酸:伴随管理二甲苯氧庚酸(每天两次口服600毫克),CYP2C8抑制剂,吡格列酮(口服30毫克)与二甲苯氧庚酸预处理的2天前10个健康志愿者(口服600毫克每日两次)导致吡格列酮暴露(AUC0-24) 226%的吡格列酮暴露在缺乏二甲苯氧庚酸(见预防措施、药物相互作用、盐酸吡格列酮)。1
利福平:伴随管理利福平(口服600毫克每日一次),一个诱导物的CYP2C8吡格列酮(口服30毫克)预处理的5天前10个健康志愿者与利福平(口服600毫克每日一次)导致减少(见AUC吡格列酮的54%预防措施、药物相互作用、盐酸吡格列酮)。2
在其他药物之间相互作用的研究中,吡格列酮对盐酸非索非那定的药物代谢动力学情况没有显著影响,二甲双胍,地高辛,华法林,雷尼替丁或茶碱。
Glimepiride
磺酰脲类药物的降糖作用可能会使某些药物,包括非甾体类抗炎药和其他高度蛋白结合的药物,如水杨酸盐、磺酰胺类、氯霉素、香豆素、丙磺舒、单胺氧化酶抑制剂和β肾上腺素能阻止代理。由于这些药物和glimepiride之间潜在的药物相互作用,应密切观察病人的低血糖时这些药物是流行性流感减毒活疫苗。相反,当这些药物被撤销,应密切观察病人血糖控制的损失。
某些药物会产生高血糖和可能导致失控。这些药物包括利尿剂和其他利尿剂、糖皮质激素、吩噻嗪类、甲状腺产品、雌激素、口服避孕药、苯妥英、烟酸、拟交感神经和异烟肼。由于这些药物和glimepiride之间潜在的药物相互作用,应密切观察病人的血糖控制时,这些药物是流行性流感减毒活疫苗。相反,当这些药物被撤销,应密切观察病人的低血糖。
阿司匹林:合并施打阿司匹林(每日三次,每次1 g)和glimepiride导致平均降低34% glimepiride AUC,因此,增加34%意味着CL / f。C均值马克斯减少4%。血糖和血清c -肽浓度不受影响,无低血糖症状报告。汇集来自临床试验的数据显示,没有证据的临床显著不良与不受控制的并发交互管理的阿司匹林和其他水杨酸盐。
西咪替丁、雷尼替丁:合并施打西咪替丁(800毫克每日一次)或雷尼替丁(150毫克每日两次)和一个4毫克口服剂量的glimepiride没有显著改变glimepiride的吸收和性格,并没有出现低血糖症状差异。汇集来自临床试验的数据显示,没有证据的临床重大不良相互作用控制并发H2-receptor拮抗剂。
普萘洛尔:伴随管理心得安(每日三次,每次40毫克)和glimepiride显著增加C马克斯、AUC T1/2 glimepiride的23%,22%,和15%,分别,CL / f下降了18%。从尿液M1和M2的恢复,然而,并没有改变。药效学反应glimepiride是几乎相同的正常受试者接受心得安和安慰剂。合并2型糖尿病患者的临床试验数据表明,没有证据表明临床重大不良与不受控制的并发管理β受体阻滞剂。然而,如果使用β受体阻断剂,应该小心谨慎和病人应该警告潜在的低血糖。
华法令阻凝剂:伴随glimepiride管理局(4毫克每日一次)并没有改变R的药代动力学特点,S-warfarin对映体后管理单一的外消旋华法林剂量(25毫克)健康受试者。没有变化观察华法林血浆蛋白结合。Glimepiride治疗导致轻微,但显著降低华法林的药效学反应。减少意味着凝血酶原时间(PT)曲线下的面积和最大PT值glimepiride治疗期间非常小(分别为3.3%和9.9%)和不太可能是临床上重要的。
雷米普利:反应血清葡萄糖、胰岛素、c -肽、血浆胰高血糖素2毫克glimepiride未受影响的合并施打雷米普利(一种ACE抑制剂)5毫克每天一次在正常科目。没有报道低血糖症状。合并2型糖尿病患者的临床试验数据表明,没有证据表明临床重大不良相互作用控制并发血管紧张素转换酶抑制剂。
咪康唑:一个潜在的口服咪康唑和口服降糖药物之间的相互作用导致严重低血糖被报道。与静脉注射这种交互是否也会发生,局部或咪康唑阴道制剂是不清楚。有一个潜在的交互glimepiride抑制剂(如氟康唑)和诱导细胞色素P450 2 c9(如利福平)。
虽然没有特定的相互作用研究进行glimepiride,汇集来自临床试验的数据显示,没有证据的临床显著不良与不受控制的并发交互管理的钙通道阻滞剂,雌激素,一类,非甾体抗炎药,HMG - CoA还原酶抑制剂,磺胺类药,或甲状腺激素。
药效学和临床效果
盐酸吡格列酮
临床研究表明,吡格列酮改善胰岛素敏感性在胰岛素抵抗患者。吡格列酮增强细胞对胰岛素的响应能力,增加胰岛素依赖型葡萄糖处理,改善肝脏对胰岛素的敏感性,改善不正常葡萄糖体内平衡。在2型糖尿病患者,降低胰岛素抵抗产生的吡格列酮导致较低的血糖浓度,降低血浆胰岛素水平,降低糖化血红蛋白值。基于从一个开放的扩展研究,吡格列酮的降糖效果似乎将持续至少一年。在对照临床研究中,吡格列酮结合磺酰脲类添加剂对血糖控制的影响。
血脂异常患者中包括安慰剂对照与吡格列酮单一疗法的临床研究。总的来说,与吡格列酮治疗的患者已经意味着减少甘油三酯,意味着增加高密度脂蛋白胆固醇,和不一致的意思是低密度脂蛋白胆固醇和总胆固醇的变化相比安慰剂组。类似的模式被认为在16周和24周的结果与磺酰脲类吡格列酮联合治疗的研究。
Glimepiride
轻微的降糖效果的单剂量口服后第一次出现在健康受试者低至0.5 - -0.6毫克。所需的时间达到最大效应(即。、最小血糖水平(T最小值])是2到3个小时。在2型糖尿病患者中,两个小时空腹和餐后血糖水平显著降低了glimepiride(1、2、4、8毫克每日一次)比口服剂量的安慰剂后14天。所有积极治疗组的降糖效果的保持在24小时。
在较大的dose-ranging研究、血糖和糖化血红蛋白被发现在剂量依赖性的方式回应的范围glimepiride 1到4毫克/天。一些患者,特别是那些有更高的空腹血浆葡萄糖(台塑)水平,可能受益于剂量的glimepiride 8毫克每日一次。没有区别的反应被发现当glimepiride管理每日一次或两次。
两尽早,安慰剂对照研究720例,平均净减少患者糖化血红蛋白为8毫克glimepiride一旦每日2.0%绝对单位与接受安慰剂的病人。在一段长期的、随机、安慰剂对照的研究2型糖尿病患者对饮食管理、glimepiride疗法改善餐后胰岛素/ c -肽的反应,和75%的患者获得并维持控制血糖和糖化血红蛋白。疗效结果不受年龄、性别、体重、或种族。在长期扩展试验以前治疗的患者,没有有意义的恶化意味着空腹血浆葡萄糖(台塑)或糖化血红蛋白水平被认为经过两年半的glimepiride治疗。
Glimepiride疗法是有效的控制血糖没有有害的血浆脂蛋白的变化对2型糖尿病患者。
临床研究
没有与Duetact临床疗效研究。然而,单独的组件的有效性和安全性之前建立。合并施打吡格列酮和磺酰脲类,包括glimepiride,评估两项临床研究的有效性和安全性。这些临床研究建立一个额外的好处的吡格列酮不足控制2型糖尿病患者的血糖控制在磺酰脲类治疗。生物等效性与流行性流感减毒活疫苗Duetact吡格列酮和glimepiride平板电脑演示了在30毫克/ 2毫克和30毫克/ 4毫克剂量的优点(见临床药理学、药物动力学和药物代谢、吸收和生物利用度)。
吡格列酮的临床研究提供附加磺酰脲类治疗的患者没有充分控制
两treatment-randomized,对照临床研究2型糖尿病患者的安全性和有效性进行评价吡格列酮+磺酰脲类。这两项研究包括患者接受磺酰脲类、单独或与另一个的降糖药,血糖控制不足。不含磺酰脲类代理,所有其他降糖药特工在开始研究之前停止治疗。在第一项研究中,560名患者被随机分配接受15毫克或30毫克的吡格列酮或安慰剂每天一次除了他们当前的磺酰脲类方案16周。在第二项研究中,702名患者被随机分配接受30毫克或45毫克吡格列酮的每天一次除了他们当前的磺酰脲类方案为24周。
在第一项研究中,吡格列酮的加入15毫克或30毫克每天一次与磺酰脲类治疗16周后显著降低平均糖化血红蛋白0.88%和1.28%,意味着台塑39.4 mg / dL和57.9 mg / dL,分别从观察与磺酰脲类单独治疗。在第二项研究中,从基线在24周平均减少30毫克糖化血红蛋白分别为1.55%和1.67%,45毫克剂量,分别。意味着减少从基线在台塑51.5 mg / dL和56.1 mg / dL,分别。基于这些降低糖化血红蛋白和台塑(表2),新增的吡格列酮磺酰脲类导致显著改善血糖控制无关的磺酰脲类用量。
表2。血糖参数在16周和24周盐酸吡格列酮+磺酰脲类组合研究
| 参数 | 安慰剂+磺酰脲类 | 吡格列酮15毫克+磺酰脲类 | 吡格列酮30毫克+磺酰脲类 | |
| 16周的研究 | ||||
| *从基线p 0.050‰¤显著变化 安慰剂+磺酰脲类的€显著差异,p 0.050‰¤ (一)实现了患者糖化血红蛋白‰¤‰¥6.1%或0.6%减少从基线 |
||||
糖化血红蛋白(%)
|
N = 181
|
N = 176
|
N = 182
|
|
| 应答率(%)(一) | 23.8 | 56.8 | 74.2 | |
台塑(mg / dL)
|
N = 182
|
N = 179
|
N = 186
|
|
| 参数 | 吡格列酮30毫克+磺酰脲类 | 吡格列酮45毫克+磺酰脲类 | ||
| 24周的研究中 | ||||
糖化血红蛋白(%)
|
N = 340
|
N = 332
|
||
| 应答率(%)(一) | 77.4 | 79.5 | ||
台塑(mg / dL)
|
N = 338
|
N = 329
|
||
| 应答率(%)(b) | 63.6 | 71.1 | ||
适应症和用法
Duetact表示作为辅助饮食和锻炼,每日一联合治疗改善2型糖尿病患者血糖控制的那些已经处理吡格列酮和磺酰脲类或其糖尿病不充分控制仅与磺酰脲类,或患者最初的反应仅吡格列酮和需要额外的血糖控制。
2型糖尿病管理还应该包括营养咨询,根据需要减肥,和锻炼。这些努力是重要的不仅在主要的治疗2型糖尿病,但也维持药物治疗的疗效。
禁忌症
患者开始Duetact建立纽约心脏协会(NYHA)类III或IV心脏衰竭是禁忌黑框警告)。
此外,Duetact患者的禁忌:
- 已知的过敏吡格列酮,glimepiride Duetact或其他组成部分。
- 糖尿病酮症酸中毒,有或没有昏迷。这种情况应该用胰岛素治疗。
警告
Glimepiride
特别警告心血管死亡的风险增加
据报道口服降糖药物管理与心血管死亡率增加有关相比与饮食单独或饮食加胰岛素治疗。这个警告是基于大学组糖尿病的研究计划(UGDP),一个长期的、前瞻性的临床试验旨在评估降糖药物的有效性在预防或延迟非胰岛素依赖糖尿病患者的血管并发症。这项研究涉及了823名患者被随机分配到一个四个治疗组(糖尿病、19增刊。2:747 - 830,1970)。
UGDP报道,患者治疗5到8年饮食+固定剂量的甲苯磺丁脲(每天1.5克)有心血管死亡率大约2 - 1/2倍的患者的饮食。观测到的总死亡率没有显著增加,但使用甲苯磺丁脲停止基于心血管死亡率的增加,因此限制了研究机会展示整体死亡率的增加。尽管争议的解释这些结果,UGDP研究的结果提供充分依据这个警告。这个病人应该知情的潜在风险和优点glimepiride平板电脑和替代的治疗模式。
虽然只有一种药物磺酰脲类类(甲苯磺丁脲)是包括在这项研究中,谨慎的从安全的角度考虑,这个警告可能也适用于其他在这个类中,口服降糖药物针对的相似之处的行动和化学结构模式。
盐酸吡格列酮
心力衰竭和其他心脏的影响
吡格列酮,与其他thiazolidinediones一样,会导致液体潴留当单独使用或结合其他抗糖尿病的药物,包括胰岛素。液体潴留可能导致或加剧心脏衰竭。病人应该被观察到心脏衰竭的症状和体征。如果这些迹象和症状,心脏衰竭应根据当前标准的护理管理。此外,停止或减少剂量吡格列酮的必须被考虑。患者NYHA III和IV类心脏地位并不在预先批准的临床试验和研究吡格列酮在这些患者不推荐(见黑框警告和禁忌症)。
在一个美国16周的双盲,安慰剂对照的临床试验包括566名2型糖尿病患者,在15毫克和30毫克剂量的吡格列酮结合胰岛素与胰岛素治疗。这个试验包括长期糖尿病患者和高患病率的预先存在的医疗条件如下:动脉高血压(57.2%),周围神经病变(22.6%)、冠心病(19.6%)、视网膜病变(13.1%)、心肌梗死(8.8%)、血管疾病(6.4%)雷竞技到底好不好用、心绞痛(4.4%)、中风或短暂性脑缺血发作(4.1%),和充血性心力衰竭(2.3%)。
在这项研究中,191名患者接受的两个15毫克吡格列酮+胰岛素(1.1%)和188年的两个病人接受30毫克吡格列酮+胰岛素发达充血性心力衰竭(1.1%)相比,胰岛素治疗的187名患者。所有这四个病人以前历史的心血管疾病包括冠心病、前CABG手术,和心肌梗死。雷竞技到底好不好用在24周dose-controlled研究吡格列酮与胰岛素coadministered, 0.3%的病人在30毫克(1/345)和0.9%(3/345)的患者在45毫克瑞士法郎为严重不良事件报告。
从这些研究没有确定具体的分析数据预测增加充血性心力衰竭的风险因素与胰岛素联合治疗。
在2型糖尿病和充血性心力衰竭(收缩功能障碍)
24周上市后安全性研究比较吡格列酮(n = 262),格列本脲(n = 256)在不受控制的糖尿病患者(平均糖化血红蛋白8.8%基线)与NYHA类II和III心脏衰竭和射血分数小于40%(平均EF 30%基线)。一夜之间在研究过程中,对充血性心力衰竭住院在9.9%的患者报告吡格列酮相比,4.7%的患者在格列本脲治疗不同观察6周。这与吡格列酮更相关的不良事件标志着患者使用胰岛素的患者在基线和超过64岁。没有区别观察治疗组之间的心血管死亡率。
吡格列酮应该开始在批准的最低剂量如果是规定对2型糖尿病患者和收缩期心衰(NYHA类II)。如果后续剂量升级是必要的,应逐渐增加剂量后才几个月的治疗,注意监测体重增加,水肿,或瑞士法郎恶化(见的症状和体征剂量和管理、特殊患者群体)。
未来的吡格列酮的临床试验在Macrovascular事件(主动)
5238年主动,2型糖尿病患者和macrovascular疾病治疗的前历史ACTOS (n = 2605), force-titrated 45毫克每天一次,或安慰剂(n = 2633)(见不良反应)。患者的比例严重心力衰竭的一个事件是患者高ACTOS (5.7%, n = 149)比服用安慰剂的患者(4.1%,n = 108)。死亡的发生率后续报告严重的心力衰竭是1.5% (n = 40)匹格列酮和1.4%患者在接受安慰剂的患者(n = 37)。在基线患者insulin-containing养生法,严重心力衰竭的发生率为6.3%(54/864例)和ACTOS (n = 47/896)与安慰剂组5.2%。对于那些患者在基线sulfonylurea-containing方案,严重心力衰竭的发生率为5.8% (n = 94/1624)匹格列酮和4.4% (n = 71/1626)与安慰剂。
预防措施
一般
盐酸吡格列酮
吡格列酮对其降糖药效果只有在胰岛素的存在。因此,患者不应使用Duetact 1型糖尿病或糖尿病酮症酸中毒的治疗。
低血糖:患者接受联合吡格列酮与胰岛素或口服降糖药物可能是低血糖的风险,并减少剂量的伴随代理可能是必要的。
心血管:在美国安慰剂对照临床试验,排除纽约心脏协会(NYHA)类患者III和IV心脏状态,严重心脏不良事件的发生率与体积膨胀并不增加患者与磺脲类或二甲双胍吡格列酮作为单药治疗与安慰剂治疗患者。在胰岛素结合研究中,少数患者以前的历史已有心脏病发达与吡格列酮治疗充血性心力衰竭时结合胰岛素(见警告盐酸吡格列酮,心力衰竭,其他心脏影响)。患者NYHA III和IV类心脏地位没有研究吡格列酮预先批准的临床试验。吡格列酮并不表示患者NYHA III或IV心脏状态类。
与吡格列酮上市后经验,已报告例充血性心力衰竭的病人都有或没有先前已知的心脏病。
水肿:在美国所有临床试验与吡格列酮,水肿报道更频繁地与吡格列酮治疗的患者比服用安慰剂的患者和似乎是(见剂量相关不良反应盐酸吡格列酮)。在上市后的经验中,启动或恶化的报道水肿已收到。thiazolidinediones以来,包括吡格列酮,会导致液体潴留,从而加剧或导致充血性心力衰竭,应小心使用Duetact病人心脏衰竭的风险。应监测患者的体征和症状心力衰竭(见黑框警告,警告、盐酸吡格列酮预防措施病人的信息)。
体重:体重剂量相关的观察与吡格列酮单独和结合其他降糖剂(表3),体重增加的机制尚不清楚,但可能包括液体潴留和脂肪积累的组合。
表3。体重(公斤)从基线变化与吡格列酮在双盲临床试验
| 对照组(安慰剂) | 吡格列酮15毫克 | 吡格列酮30毫克 | 吡格列酮45毫克 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 中位数 (25日/ 75 thpercentile) |
中位数 (25日/ 75 thpercentile) |
中位数 (25日/ 75 thpercentile) |
中位数 (25日/ 75 thpercentile) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 注意:16至26周的试验持续时间 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 单药治疗 | -1.4 (-2.7/0.0) n = 256 |
0.9 (-0.5/3.4) n = 79 |
1.0 (-0.9/3.4) n = 188 |
2.6 (0.2/5.4) n = 79 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 联合治疗 | 磺酰脲类 二甲双胍 胰岛素 |
-0.5 (-1.8/0.7) n = 187 -1.4 (-3.2/0.3) n = 160 0.2 (-1.4/1.4) n = 182 |
2.0 (0.2/3.2) n = 183 N /一个 2.3 (0.5/4.3) n = 190 |
3.1 (1.1/5.4) n = 528 0.9 (-0.3/3.2) n = 567 3.3 (0.9/6.3) n = 522 |
4.1 (1.8/7.3) n = 333 1.8 (-0.9/5.0) n = 407 4.1 (1.4/6.8) n = 338 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
排卵:与吡格列酮治疗,和其他thiazolidinediones一样,可能会导致在某些绝经前阻止排卵的女性排卵。因此,适当的避孕应该推荐服用Duetact在绝经前妇女。这可能效果没有进行临床研究所以这发生的频率是不清楚。
血液:在所有临床研究与吡格列酮、平均血红蛋白值下降了2%至4%与吡格列酮治疗的患者。这些变化主要发生在第一个4到12周的治疗和保持相对恒定。这些变化可能与增加等离子体体积和很少与任何显著相关(见血液的临床效果不良反应盐酸吡格列酮、实验室异常,血液)。Duetact可能导致减少血红蛋白和血细胞比容。
肝的影响:在预先批准临床研究在世界范围内,超过4500个受试者与吡格列酮治疗。在美国的临床研究中,超过4700名2型糖尿病患者接受了吡格列酮。没有证据表明药物引起的肝毒性或海拔ALT水平的临床研究。
在预先批准安慰剂对照临床试验在美国,a total of 4 of 1526 (0.26%) patients treated with pioglitazone and 2 of 793 (0.25%) placebo-treated patients had ALT values ≥ 3 times the upper limit of normal. The ALT elevations in patients treated with pioglitazone were reversible and were not clearly related to therapy with pioglitazone.
与吡格列酮上市后经验,肝炎和肝酶的报道海拔上限3次以上正常的收到了。很少,这些报告都涉及肝衰竭和没有致命的结果,虽然因果关系尚未建立。
等待结果的额外的可用性大,长期控制吡格列酮临床试验和上市后额外的安全数据,建议患者Duetact进行定期监测肝酶。
血清ALT水平(丙氨酸转氨酶)应该评估开始之前与Duetact治疗所有患者此后定期/医疗专业的临床判断。肝功能测试也应该获得患者如果出现提示为肝脏功能障碍的症状,如恶心、呕吐、腹痛、疲劳,厌食,或尿色深。决定是否继续治疗的病人Duetact应该遵循临床判断等待实验室评估。如果观察黄疸,应停止药物治疗。
治疗Duetact不应启动如果病人表现出活跃的肝脏疾病的临床证据或ALT水平超过正常上限的2.5倍。轻度患者肝酶升高(ALT水平1正常上限的2.5倍)治疗期间基线或任何时候Duetact应该评估来确定肝酶升高的原因。与Duetact开始或继续治疗轻度肝酶升高的患者应谨慎行事,包括适当的临床随访其中可能包括更频繁的监测肝酶。如果血清转氨酶水平增加(ALT >正常上限的2.5倍),肝功能测试应评估更频繁,直到恢复正常水平或预处理值。如果ALT水平超过正常上限的3倍,应尽快重复测试。如果ALT水平仍>上限的3倍正常或如果病人是有偏见的,Duetact治疗应该停止。
黄斑水肿:黄斑水肿已经在上市后经验报道糖尿病患者服用吡格列酮或另一个thiazolidinedione。一些病人出现视力模糊或视力减退,但似乎有些病人被诊断常规眼科检查。一些患者外周水肿当时黄斑水肿诊断。一些改善患者在停药后黄斑水肿的thiazolidinedione。这是未知的吡格列酮之间是否有因果关系和黄斑水肿。糖尿病患者应该定期的眼科检查,眼科医生,每照顾美国糖尿病协会的标准。此外,任何糖尿病患者视觉症状应立即报告任何类型的眼科医生,不管病人的潜在药物或其他物理结果(见不良反应)。
骨折:一项随机试验(主动)在2型糖尿病患者糖尿病病程(平均9.5年),增加骨折的发病率在女性患者服用吡格列酮。在平均随访34.5个月,骨折的发病率在女性是5.1%吡格列酮(44/870)和2.5%(23/905)的安慰剂。这种差异指出的第一年治疗后,仍在研究过程中。大多数骨折女性患者中观察到nonvertebral骨折包括下肢和上肢远端。没有观察到骨折率增加男性对待吡格列酮1.7%(30/1735)和安慰剂组2.1% (37/1728)。骨折的风险应考虑在照顾患者,尤其是女性患者,与吡格列酮治疗应注意评估和维护骨骼健康根据目前的护理标准。
一般
Glimepiride
低血糖:磺酰脲类药物能产生严重的低血糖。适当的病人选择、剂量和指令是重要的,以避免低血糖发作。肾功能受损的患者可能更敏感glimepiride的降糖效果。1毫克的起始剂量glimepiride并采取适当的剂量滴定建议每天一次在这些患者剂量和管理、特殊患者群体)。使衰弱或营养不良的患者,肾上腺、垂体,或肝功能不全是特别容易受到降糖药物的降糖作用。低血糖可能很难识别在老年人和那些服用该项阻断药物或其他阻滞交感神经的代理。低血糖时更容易发生热量摄取不足,严重或长时间的锻炼后,酒精摄入时,或者当使用一个以上的降糖药物。结合使用glimepiride胰岛素和二甲双胍可能会增加低血糖的可能性。
血糖失控:当病人稳定在任何糖尿病疗法是暴露在压力如发烧、外伤,感染,或手术,可能会失去控制。任何口服降糖药物的有效性,包括Duetact,降低所需的血糖水平下降很多病人在一段时间内,这可能是由于糖尿病的严重程度的进展或减少响应性药物。
实验室测试
台塑和糖化血红蛋白测量应该定期执行Duetact监控血糖控制和治疗反应。
肝酶监测建议治疗开始之前Duetact定期在所有患者和此后每医疗专业的临床判断(见预防措施将军:盐酸吡格列酮,和肝脏的影响不良反应盐酸吡格列酮、实验室异常,血清转氨酶水平)。
信息对病人
病人应该被指示关于坚持饮食指导的重要性,定期锻炼,定期检测血糖和糖化血红蛋白。期间的压力如发烧、外伤,感染,或手术,药物的需求可能会改变和病人应提醒及时就医。患者还应通知的潜在风险和优点Duetact和替代的治疗模式。
起始Duetact疗法之前,低血糖的风险,它的症状和治疗,和条件,使其发展应向病人解释和负责任的家庭成员(见雷竞技到底好不好用预防措施将军:盐酸吡格列酮和Glimepiride,低血糖)。联合治疗与其他降糖药Duetact代理也可能引起低血糖。
患者经历异常快速的体重增加和水肿或开发气短或其他心脏衰竭的症状在Duetact这些症状应立即报告医生。
患者应该被告知为肝功能血液测试将开始之前进行治疗和定期此后每医疗专业的临床判断。患者应该被告知立即寻求医疗建议为不明原因的恶心、呕吐、腹痛、乏力、厌食,或尿色深。
与thiazolidinedione疗法,包括积极吡格列酮Duetact平板电脑的组件,可能会导致在某些绝经前阻止排卵的女性排卵。因此,这些患者可能在服用Duetact怀孕的风险增加。这可能效果没有进行临床研究所以这发生的频率是不清楚。因此,足够的绝经前妇女的避孕应该推荐。病人在Duetact怀孕或计划怀孕应该建议与他们的医生讨论方案适合维持充足的血糖控制(见预防措施怀孕:怀孕范畴C)。
患者应该被告知采取单一剂量的Duetact每天一次与第一主餐和指示,任何剂量的变化应该只有由他们的医生剂量和管理最大推荐剂量)。
药物的相互作用
盐酸吡格列酮
体内药物之间相互作用的研究表明,吡格列酮可能是弱CYP 3 a4 450对碘氧基苯甲醚衬底的诱导物。
CYP2C8酶抑制剂(如二甲苯氧庚酸)可以显著提高CYP2C8的AUC吡格列酮和酶的诱导物(如利福平)可以显著减少AUC吡格列酮的。因此,如果一个抑制剂或诱导物的CYP2C8启动或停止与吡格列酮治疗期间,糖尿病治疗的变化可能需要根据临床反应(见临床药理学药物之间的相互作用,盐酸吡格列酮)。
Glimepiride
(见临床药理学药物之间的相互作用,Glimepiride)
致癌作用、诱变、生育能力的障碍
Duetact
与Duetact没有进行动物实验。以下数据是基于研究发现与吡格列酮或glimepiride单独执行。
盐酸吡格列酮
两年致癌性研究在雄性和雌性大鼠口服剂量63毫克/公斤(约14倍的最大推荐人类45毫克口服剂量的基于mg / m2)。药物引起肿瘤没有观察到任何器官除了膀胱。良性或恶性移行细胞肿瘤观察在雄性老鼠4毫克/公斤/天以上(约等于最大建议人类口服剂量基于mg / m2)。两年致癌性研究在雄性和雌性小鼠口服剂量100毫克/公斤/天(约11倍的最大推荐人类口服剂量基于mg / m2)。没有观察到任何器官药物引起肿瘤。
在未来的评估涉及超过1800患者的尿细胞学吡格列酮在临床试验中到一年的时间,没有发现膀胱肿瘤的新病例。在3年的两个研究吡格列酮与安慰剂或格列本脲,有16/3656(0.44%)的报道膀胱癌患者服用吡格列酮相比,5/3679(0.14%)的患者没有服用吡格列酮。排除接触研究药物的病人不到一年在膀胱癌诊断的时候,吡格列酮有6例(0.16%),安慰剂的两个(0.05%)。
盐酸吡格列酮不是诱变遗传毒理学研究的电池,包括艾姆斯细菌化验,向前一个哺乳动物细胞基因突变试验(CHO /产生HPRT和AS52 / XPRT),一个背影细胞,体外细胞遗传学分析使用一个非常规DNA合成试验,体内微核测定。
没有观察到不良的影响生育率在雄性和雌性大鼠口服剂量高达40毫克/公斤盐酸吡格列酮日常之前和在交配和妊娠期(约9倍的最大推荐人类基于mg / m口服剂量2)。
Glimepiride
对老鼠的研究在全价配合饲料的剂量的5000 ppm(大约人类最大推荐剂量的340倍,基于面积)为30个月没有致癌作用的证据。在老鼠中,24个月glimepiride管理导致增加良性胰腺腺瘤形成剂量有关,被认为是慢性胰腺刺激的结果。腺瘤的形成没有影响剂量的小鼠在这个研究是在完成320 ppm的饲料,或46 - 54岁毫克/公斤体重/天。这是人类的最大推荐剂量的35倍基于面积8毫克,每日一次。
Glimepiride non-mutagenic在一连串的体外和体内诱变研究(艾姆斯测试中,体细胞突变,染色体畸变,非常规DNA合成,小鼠微核测试)。
没有动物,其glimepiride对雄性小鼠生殖的影响高达2500毫克/公斤体重(> 1700次人类最大推荐剂量基于面积)。Glimepiride没有影响雄性和雌性大鼠的生育管理高达4000毫克/公斤体重(大约4000倍人类最大推荐剂量基于面积)。
动物毒理学
盐酸吡格列酮
心脏扩大一直在观察小鼠(100毫克/公斤),老鼠(4毫克/公斤以上)和狗(3毫克/公斤)与盐酸吡格列酮口服治疗(约11、1和2倍的最大人类口头推荐剂量为老鼠,老鼠,和狗,分别基于mg / m2)。在为期一年的老鼠的一项研究中,与毒品有关的早期死亡由于明显的心脏功能障碍发生在口服剂量为160毫克/公斤/天(约35倍人类最大推荐口服剂量基于mg / m2)。心脏扩大在13周研究猴子的口服剂量的8.9毫克/公斤以上(约4倍的最大推荐人类基于mg / m2)口服剂量,但不是在52周研究口服剂量多达32毫克/公斤(约13倍的最大推荐人类口服剂量基于mg / m2)。
Glimepiride
降低血清葡萄糖值和脱粒的胰腺β细胞观察小猎犬狗接触glimepiride 320毫克/公斤/天为12个月(约1000倍人类推荐剂量基于面积)。没有证据表明在任何器官观察肿瘤形成。一个女和一个公狗发达国被膜下的白内障。Non-GLP研究表明glimepiride不太可能加剧白内障的形成。评估的潜在co-cataractogenic glimepiride在几个糖尿病和白内障大鼠模型是负面的和没有不利影响的glimepiride牛眼晶状体代谢器官文化。
怀孕
怀孕范畴C
Duetact
因为当前信息强烈表明,孕期血糖水平异常与先天性畸形的发生率更高,以及新生儿发病率和死亡率增加,大多数专家建议在怀孕期间使用胰岛素维持血糖水平尽可能接近正常。Duetact在怀孕期间不应使用,除非潜在好处证明胎儿的潜在风险。
没有足够的控制研究孕妇Duetact或单个组件。没有进行动物研究在Duetact合并后的产品。以下数据是基于研究发现与吡格列酮或glimepiride单独执行。
盐酸吡格列酮
吡格列酮并不产生畸形的在大鼠口服剂量80毫克/公斤或兔子放弃在器官形成160毫克/公斤(大约17岁,40倍的最大推荐人类基于mg / m2口服剂量,分别)。延迟分娩和胚胎毒性(就是明证postimplantation损失增加,发育延迟和减少胎儿重量)观察在大鼠口服剂量的40毫克/公斤/天以上(大约10倍最大建议人类口服剂量基于mg / m2)。没有任何功能或行为毒性观察老鼠的后代。在兔子,胚胎毒性观察到口服剂量160毫克/公斤(约40倍的最大推荐人类口服剂量基于mg / m2)。产后发育迟缓,体重下降,观察口服剂量的老鼠的后代10毫克/公斤以上妊娠后期和哺乳期期间(约2倍的最大建议人类口服剂量基于mg / m2)。
Glimepiride
畸形形成的影响:Glimepiride没有产生畸形形成的影响的老鼠暴露口服4000毫克/公斤体重(大约4000倍人类最大推荐剂量根据表面积)或兔子暴露多达32毫克/公斤体重(约60倍人类最大推荐剂量基于面积)。Glimepiride已被证明是与宫内胎儿死亡在老鼠在剂量低至50倍人类剂量根据表面积和兔子在低剂量时人体剂量基于面积的0.1倍。这fetotoxicity,只观察到剂量诱导孕产妇低血糖,已经与其他磺酰脲类药物同样指出,被认为是直接关系到glimepiride的药物(低血糖)行动。
Nonteratogenic效应:在一些研究老鼠,水坝的后代暴露于高水平的glimepiride孕期和哺乳期缩短组成的骨骼畸形发展,增厚,肱骨产后期间的弯曲。显著的浓度glimepiride观察血清和乳汁的水坝以及血清的幼崽。这些骨骼变形测定的结果从母亲接触glimepiride护理。
长期严重的低血糖(4至10天)一直在报道新生儿出生母亲服用磺酰脲类药物在交货时间。这是报道更频繁地使用代理与延长半衰期。计划怀孕的病人应该咨询他们的医生,并建议他们改变了胰岛素在整个孕期和哺乳期。
哺乳期妇女
没有进行研究,结合Duetact的组成部分。与研究执行单个组件,吡格列酮分泌的牛奶哺乳期大鼠和显著的浓度glimepiride观察血清和乳汁的水坝和幼崽的血清。现在还不知道是否吡格列酮glimepiride在母乳分泌。然而,其他磺酰脲类药物在母乳分泌。因为低血糖的可能性在护理婴儿可能存在,因为对哺乳动物的影响,Duetact不应该为一个女人母乳喂养。如果Duetact停止,如果饮食本身不能控制血糖,胰岛素治疗应考虑(见预防措施怀孕:怀孕范畴C, Glimepiride Nonteratogenic效应)。
儿童使用
Duetact在儿科患者的安全性和有效性尚未建立。
老年人使用
盐酸吡格列酮
吡格列酮的大约500名患者在安慰剂对照临床试验是65。无显著差异,有效性和安全性观察这些病人和年轻患者之间的关系。
Glimepiride
608年美国glimepiride临床研究,对1986例65岁以上。没有观察到整体安全性或有效性的差异之间的这些主题和年轻的学科,但更大的敏感性一些老年人的可能性不能排除。
比较glimepiride药物动力学在2型糖尿病患者‰¤(n = 49)和65年> 65年(n = 42)进行的一项研究使用6毫克每日给药方案。之间没有明显的差异glimepiride药物动力学两个年龄组(见临床药理学特殊人群,老年人:Glimepiride)。
Glimepiride明显是由肾脏排出,和这种药物不良反应的风险可能更大的患者的肾功能受损。因为老年患者更可能有肾功能下降,应注意剂量选择,它可能是有用的监测肾功能。
老年患者尤其容易受到降糖药物的降糖作用。疲惫不堪的老人,或营养不良的患者,患者的肾和肝功能不全,初始剂量,剂量增加和维护用量应该保守根据血糖水平之前和之后开始的治疗,以避免低血糖反应。低血糖可能很难识别在老年人和那些服用该项阻断药物或其他阻滞交感神经的代理(参见临床药理学特殊人群,肾功能不全:Glimepiride;预防措施,一般:Glimepiride、低血糖和剂量和管理、特殊患者群体)。
不良反应
至少5%的患者报告的不良事件之间的控制16周临床研究安慰剂+磺酰脲类、吡格列酮(15毫克和30毫克的总和)+ sulfonylurea-treatment武器是上呼吸道感染(15.5%和16.6%),意外伤害(8.6%和3.5%)和合并水肿/外围水肿(2.1%和7.2%),分别为。
报告的不良事件发生率和类型至少有5%的患者在任何联合吡格列酮治疗组24周的研究比较30毫克+吡格列酮磺酰脲类和45毫克+磺酰脲类表4所示;不良事件导致的速度研究中止两治疗组之间的6.0%和9.7%,分别。
表4。不良事件发生在一个‰¥在任何治疗组5%的患者在24周的研究
| 不良事件 | 吡格列酮30毫克+磺酰脲类 N = 351 n (%) |
吡格列酮45毫克+磺酰脲类 N = 351 n (%) |
| 低血糖症 | 47 (13.4) | 55 (15.7) |
| 上呼吸道感染 | 43 (12.3) | 52 (14.8) |
| 体重增加了 | 32 (9.1) | 47 (13.4) |
| 水肿下肢 | 20 (5.7) | 43 (12.3) |
| 头痛 | 25 (7.1) | 14 (4.0) |
| 尿路感染 | 20 (5.7) | 24 (6.8) |
| 腹泻 | 21日(6.0) | 15 (4.3) |
| 恶心 | 18 (5.1) | 14 (4.0) |
| 肢体疼痛 | 19日(5.4) | 14 (4.0) |
报道在美国双盲研究中,贫血患者‰¤2%的吡格列酮+磺酰脲类(见预防措施将军:盐酸吡格列酮)。
盐酸吡格列酮
超过8500名2型糖尿病患者与吡格列酮治疗的随机、双盲、对照的临床试验。这包括2605年高风险与吡格列酮治疗2型糖尿病患者的前瞻性的临床试验。超过6000名患者治疗6个月或更长时间,和超过4500名患者一年或更长时间。超过3000病人得到吡格列酮至少2年。
大多数临床不良事件之间的相似与吡格列酮治疗组与磺酰脲类和吡格列酮治疗单一疗法。其他不良事件报道至少有5%的患者在安慰剂对照临床研究和吡格列酮单一疗法包括肌痛(2.7%和5.4%),牙障碍(2.3%和5.3%),糖尿病加重(8.1%和5.1%)和咽炎(0.8%和5.1%),分别为。
在单一疗法研究中,水肿被报道为4.8%(从7.5毫克剂量45毫克)吡格列酮和1.2%的安慰剂治疗患者治疗的患者。大多数的这些事件被认为是轻度或中度强度(见预防措施将军:盐酸吡格列酮、水肿)。
未来的吡格列酮的临床试验在Macrovascular事件(主动)
5238年主动,2型糖尿病患者和macrovascular疾病治疗的前历史ACTOS (n = 2605), force-titrated 45毫克每日,或安慰剂(n = 2633),除了标准的护理。几乎所有科目(95%)接受心血管药物(β-受体阻滞剂、血管紧张素转换酶抑制剂arb,钙通道阻滞剂,硝酸盐、利尿剂、阿司匹林、他汀类药物,一类)。患者平均年龄为61.8岁,平均患糖尿病时间9.5年,和平均糖化血红蛋白8.1%。平均随访时间为34.5个月。本试验的主要目的是检查ACTOS对死亡率和macrovascular发病率的影响2型糖尿病患者的高危macrovascular事件。主要疗效变量是时间第一次出现的任何事件心血管复合端点(见表5)。匹格列酮之间尽管没有统计上的显著差异和安慰剂3年发病率的第一个事件在这个组合中,没有增加死亡率或与爱妥糖总macrovascular事件。
表5所示。第一次数量和总事件为每个组件在心血管复合端点
| 安慰剂 N = 2633 |
匹格列酮 N = 2605 |
|||
| 心血管事件 | 第一个事件 (N) |
总事件 (N) |
第一个事件 (N) |
总事件 (N) |
| 任何事件 | 572年 | 900年 | 514年 | 803年 |
| 全因死亡率 | 122年 | 186年 | 110年 | 177年 |
| 非致命性心肌梗死 | 118年 | 157年 | 105年 | 131年 |
| 中风 | 96年 | 119年 | 76年 | 92年 |
| ACS | 63年 | 78年 | 42 | 65年 |
| 心脏介入 | 101年 | 240年 | 101年 | 195年 |
| 主要的腿截肢 | 15 | 28 | 9 | 28 |
| 腿血管再生 | 57 | 92年 | 71年 | 115年 |
上市后报告新出现或恶化糖尿病黄斑水肿与降低视力也已收到(见预防措施将军:盐酸吡格列酮)。
Glimepiride
不良事件发生在与安慰剂对照临床试验和glimepiride单药治疗,除了低血糖、头痛和恶心,还包括头晕(0.3%和1.7%)和衰弱(1.0%和1.6%),分别为。
胃肠道反应:呕吐、肠胃疼痛,与glimepiride已报告和腹泻,但安慰剂对照试验的发生率低于1%。在极少数情况下,可能会有海拔肝酶水平。在孤立的情况下,肝脏功能受损(如胆汁郁积和黄疸),以及肝炎,这也可能导致肝衰竭与磺酰脲类药物已报告,包括glimepiride。
皮肤反应:皮肤过敏反应,例如,瘙痒,红斑,荨麻疹,和麻疹样的或斑丘疹的爆发,发生在不到1%的glimepiride-treated病人。这些可能是短暂的,可能除了继续使用glimepiride消失。如果这些过敏反应持续或恶化,该药物应该停止。获得性迟发性卟啉症cutanea、光敏性反应和过敏性血管炎与磺酰脲类药物已报告。
代谢反应:肝卟啉症反应和disulfiram-like反应与磺酰脲类药物已报告;然而,没有病例被报道与glimepiride平板电脑。低钠血症病例报告glimepiride和所有其他磺酰脲类药物,通常患者在其他药物或医疗条件导致低钠血症或增加抗利尿激素的释放。雷竞技到底好不好用抗利尿激素不适当的综合征(SIADH)分泌报道与某些其他磺酰脲类药物,它已经表明,这些磺酰脲类药物可能增加外围(抗利尿)抗利尿激素的作用和/或增加抗利尿激素的释放。
血液反应:白细胞减少、粒细胞缺乏症,血小板减少症,溶血性贫血,再生障碍性贫血,全血细胞减少症与磺酰脲类药物已报告。
其他反应:住宿和/或视力模糊可能发生的变化与glimepiride的使用。在glimepiride安慰剂对照试验中,视力模糊的发生率与安慰剂组为0.7%,glimepiride, 0.4%。这被认为是由于血糖的变化,和治疗开始时可能更明显。这种情况也出现在未经治疗的糖尿病患者,并可能会降低治疗。
实验室异常
盐酸吡格列酮
血液:吡格列酮可能导致减少血红蛋白和血细胞比容。血红蛋白和血细胞比容下降吡格列酮剂量相关。在所有临床研究,平均血红蛋白值下降了2%至4%与吡格列酮治疗的患者。这些变化通常发生在第一个4到12周的治疗和保持相对稳定。这些变化可能与增加等离子体体积与吡格列酮治疗和很少相关的任何重要的血液(见临床效果预防措施将军:盐酸吡格列酮、血液)。
血清转氨酶水平:在所有临床研究在美国,14of 4780 (0.30%) patients treated with pioglitazone had ALT values ≥ 3 times the upper limit of normal during treatment. All patients with follow-up values had reversible elevations in ALT. In the population of patients treated with pioglitazone, mean values for bilirubin, AST, ALT, alkaline phosphatase, and GGT were decreased at the final visit compared with baseline. Fewer than 0.9% of patients treated with pioglitazone were withdrawn from clinical trials in the U.S. due to abnormal liver function tests.
在预先批准的临床试验,没有特殊药物反应导致肝衰竭(见预防措施将军:盐酸吡格列酮,肝的影响)。
肌酸磷酸激酶水平:在需要实验室检测与吡格列酮在临床试验中,零星的,瞬态海拔在肌酸磷酸激酶(CPK)观察水平。一个孤立的高度大于上限的10倍正常发现9例(2150到11400国际单位/ L的值)。六位病人继续得到吡格列酮,两名患者完成了接受研究药物时的高价值和一个病人停用研究药物由于海拔。这些海拔解决没有任何明显临床后遗症。这些事件吡格列酮治疗的关系尚不清楚。
过量
盐酸吡格列酮
控制临床试验期间,与吡格列酮过量报道案例之一。男性患者120毫克每天花了四天,然后七天每天180毫克。患者否认有任何临床症状在此期间。
过剂量时,适当的支持性治疗应根据患者的临床症状和体征发起。
Glimepiride
过剂量的磺酰脲类药物,包括glimepiride,可以产生低血糖。轻度低血糖症状没有意识丧失或神经系统发现,应积极使用口服葡萄糖和调整药物剂量和/或餐模式。密切监测应该继续,直到医生保证病人已脱离危险。严重的低血糖反应与昏迷、没收或其他神经损伤很少发生,但构成医疗紧急情况需要立即住院治疗。如果确诊或疑似低血糖昏迷,病人应给予集中的快速静脉注射葡萄糖(50%)的解决方案。这应该是紧随其后的是一个连续注入更稀的(10%)葡萄糖溶液,将维持血糖水平高于100 mg / dL。应密切监测患者至少24至48小时,因为低血糖可能复发后明显临床康复。
剂量和管理
一般
使用的降糖药治疗2型糖尿病的管理应该是个性化的疗效和耐受性的基础上。未能遵循适当的给药方案可能导致低血糖。
剂量的建议
选择的起始剂量Duetact应该基于病人的目前吡格列酮和/或磺酰脲类的方案。降糖药的病人可能更敏感药物剂量调整期间应该严密监控。Duetact启动后,患者应仔细监控液体潴留(见相关的不良事件黑框警告和警告盐酸吡格列酮)。建议单剂Duetact一旦日常管理与第一主餐。
起始剂量为病人目前glimepiride单药治疗
基于通常的起始剂量的吡格列酮(15毫克或30毫克每天),Duetact可能发起30毫克/ 2毫克或30毫克/ 4毫克平板优势每天一次,和调整后评估适当的治疗反应。
对2型糖尿病患者和收缩功能障碍,看到的剂量和管理、特殊患者群体。
起始剂量对吡格列酮的患者目前单一疗法
基于通常的起始剂量的glimepiride(1毫克或2毫克每日一次),和吡格列酮15毫克或30毫克,Duetact可能发起30毫克/ 2毫克每天一次,和调整后评估适当的治疗反应。
患者目前不glimepiride和低血糖,可能更敏感剂量和管理、特殊患者群体。
起始剂量吡格列酮的患者从联合治疗+ glimepiride作为独立的平板电脑
Duetact可能发起30毫克/ 2毫克或30毫克/ 4毫克平板电脑的优势基于剂量的吡格列酮和glimepiride已经采取了。吡格列酮的患者不是控制15毫克结合glimepiride转向Duetact时应该仔细监控。
起始剂量患者目前在不同的磺酰脲类单药治疗或切换从吡格列酮联合治疗加上不同的磺酰脲类(如格列本脲、格列吡嗪、氯磺丙脲、甲苯磺丁脲、acetohexamide)
没有准确的剂量glimepiride和其他磺酰脲类药物之间存在的关系。因此,基于最大剂量的2毫克glimepiride开始,应该限制Duetact最初的起始剂量30毫克/ 2毫克每天一次,和调整后评估适当的治疗反应。
任何变化在糖尿病治疗中应该小心和适当的监控进行血糖控制可能发生的变化。病人应仔细观察低血糖(1 - 2周)转移到Duetact时,特别是从长半衰期磺酰脲类药物(如氯磺丙脲)由于潜在的药物作用重叠。
应给予足够的时间来评估适当的治疗反应。理想情况下,对治疗的反应应该是评估使用糖化血红蛋白,这是一个比台塑独自更好的长期血糖控制的指标。糖化血红蛋白反映血糖在过去两到三个月。在临床使用,建议患者治疗Duetact一段时间充分评估糖化血红蛋白的变化(8 - 12周),除非血糖控制以台塑恶化。
特殊患者群体
Duetact不推荐用于怀孕、哺乳期妇女或用于儿科患者。
疲惫不堪的老人,或营养不良的患者,患者的肾或肝功能不全,初始剂量,剂量增加和维护Duetact剂量应保守,以避免低血糖反应。这些病人应该开始在1毫克的glimepiride处方Duetact之前。在起始Duetact疗法和任何后续剂量调整,患者应该仔细观察低血糖(预防措施,一般:Glimepiride,低血糖)。
治疗Duetact不应启动如果病人表现出活跃的肝脏疾病的临床证据或增加血清转氨酶水平(ALT大于正常上限的2.5倍)在开始治疗(见预防措施,一般:盐酸吡格列酮,肝效果和临床药理学、特殊人群,肝功能不全:盐酸吡格列酮)。肝酶监测建议在所有患者开始治疗之前Duetact此后定期(见预防措施将军:盐酸吡格列酮,肝效果和预防措施,实验室测试)。
批准的最低剂量的Duetact治疗应该规定的2型糖尿病患者和收缩功能障碍只从15毫克滴定后30毫克的吡格列酮安全容忍。如果随后的剂量调整是必要的,患者应仔细监控体重增加,水肿,或瑞士法郎恶化(见的症状和体征警告盐酸吡格列酮,心力衰竭,其他心脏影响)。
最大推荐剂量
Duetact平板电脑可以30毫克吡格列酮+ 2毫克glimepiride或30毫克吡格列酮+ 4毫克glimepiride配方口服药。的最大推荐剂量吡格列酮是45毫克和最大glimepiride每日推荐剂量为8毫克
Duetact因此不应给予每天不止一次在平板电脑的任何优势。
如何提供
Duetact有30毫克吡格列酮+ 2毫克glimepiride或30毫克吡格列酮+ 4毫克glimepiride平板电脑如下:
30毫克/ 2毫克平板电脑:白色白色,圆形,凸,裸露的平板电脑,凹面图形与30/2一边和4833 g,可用:
NDC 30 64764-302-30瓶
NDC 90瓶64764-302-90
30毫克/ 4毫克平板电脑:白色白色,圆形,凸,裸露的平板电脑,凹面图形与30/4一边和4833 g,可用:
NDC 30 64764-304-30瓶
NDC 90瓶64764-304-90
存储
商店在25°C (77°F);远足允许15 - 30°C (59 - 86°F)(见USP室温控制)。保持容器紧密关闭,防止水分和湿度。
引用
- 邓,LJ, et al,二甲苯氧庚酸对吡格列酮的药物动力学的影响。欧元中国新药杂志2005;61:831 - 836,表1。
- Jaakkola T et al .利福平对吡格列酮的药物动力学的影响。Br中国新药杂志2006;61:1 70 - 78。
人类眼科学数据
Glimepiride
眼科检查在超过500个受试者进行了长期研究使用泰勒和西方的方法论和Laties et al . glimepiride之间没有显著差异被认为和格列本脲与临床上重要的视敏度的变化,眼内张力,或任何的五lens-related变量检查。
眼科检查期间进行了长期研究使用的方法Chylack et al。没有显著或临床有意义的glimepiride之间还是有差异的,格列吡嗪对白内障发展的主观loc II评分和客观图像分析系统、视力、眼压、和一般眼科检查。
Rx只
匹格列酮®和DuetactTM武田制药有限公司和商标使用许可下,武田制药美国公司。
分布:
武田制药美国公司。
迪尔菲尔德中学,60015
©2006年美国武田制药公司。
2007年9月05 - 1140
最后更新:09/07
Duetact,盐酸吡格列酮和glimepiride病人信息(简明英语)
信息在本专著并不打算覆盖所有可能的用途,方向,预防措施,药物的相互作用或不良影响。这个信息是广义的,并不打算具体的医疗建议。如果你有问题关于药品你正在服用或想要更多的信息,请和你的医生、药剂师、护士。
APA的参考
员工,h .(2007年9月30日)。Duetact吡格列酮Glimepiride——Duetact完整的处方信息,HealthyPlace。检索2021年5月6日从//www.lharmeroult.com/diabetes/medications/duetact-pioglitazone-glimepiride


